.gif)

-

-
2025 唾液酸酶在疾病发生、发展中的特异性作用以及它在医药领域的应用有哪些? ludger唾液酸酶 Au Alpha-(2-3,6) 货号: E-S005;参考价RMB 5524元(具体询价)
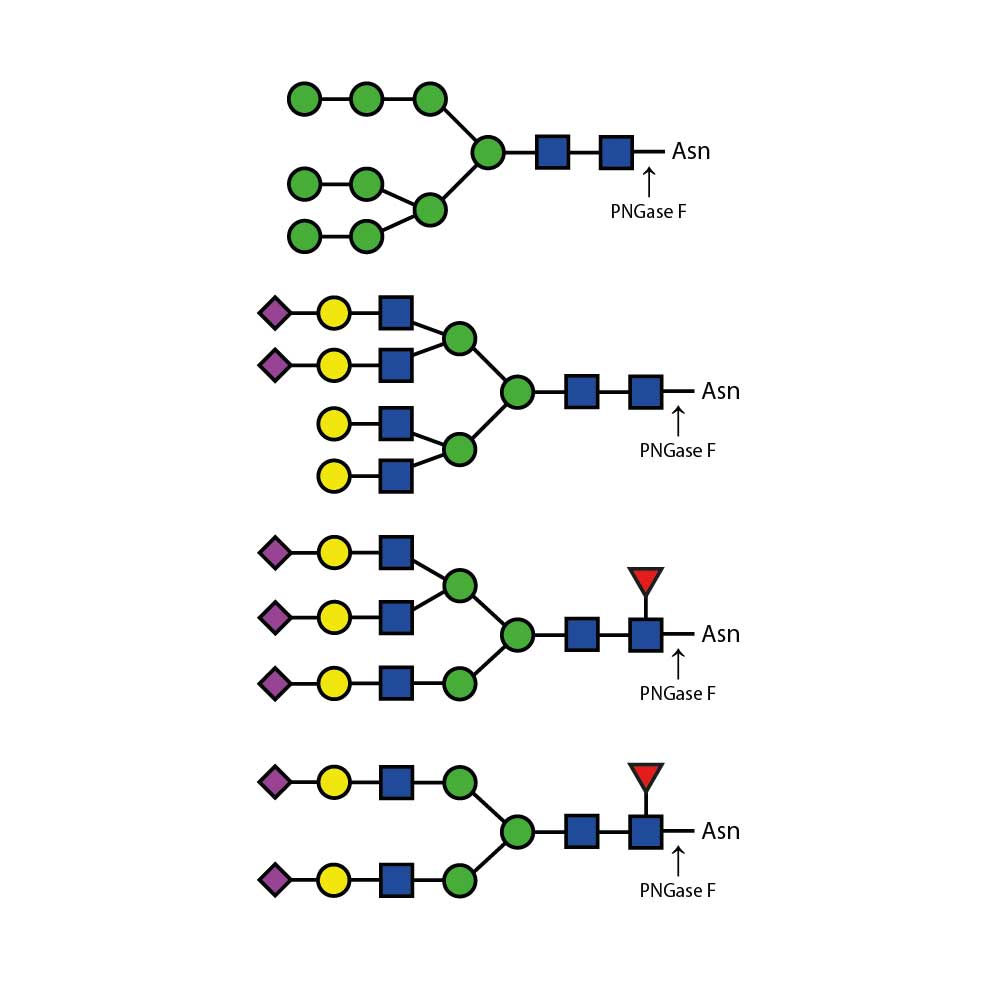
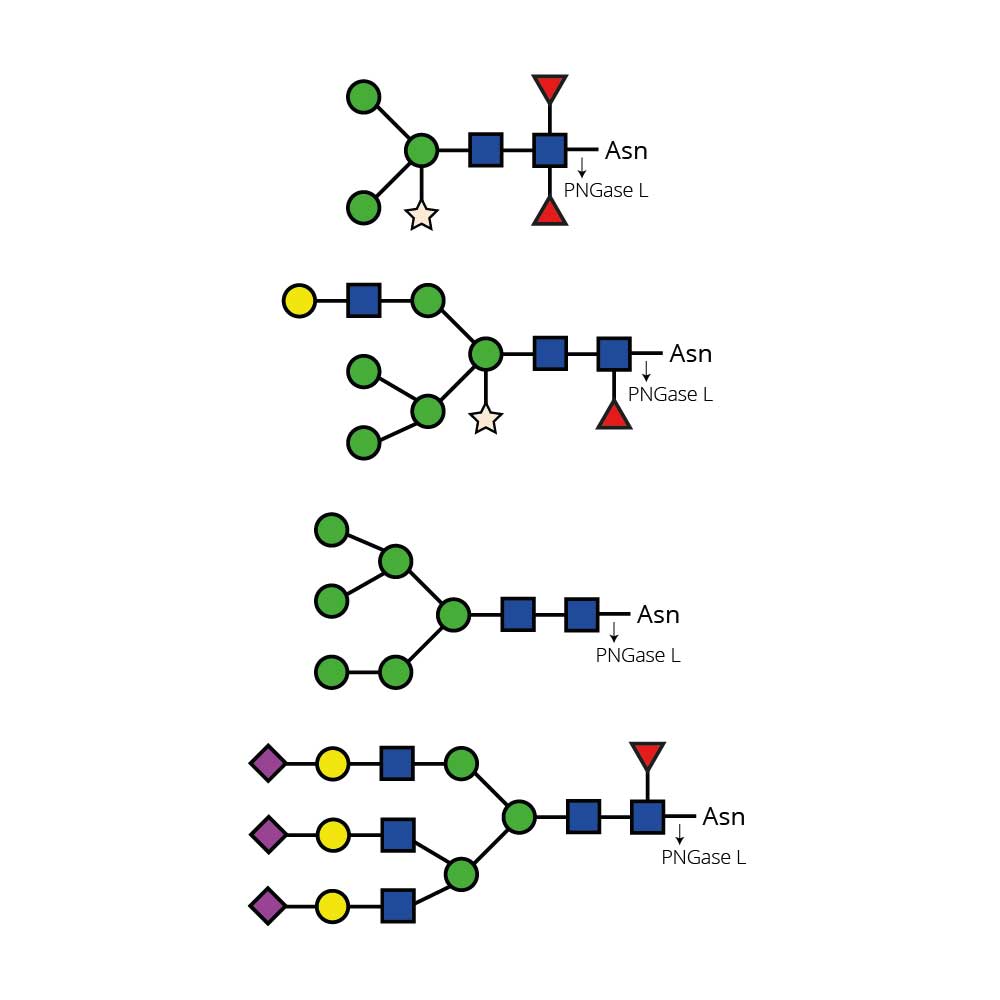
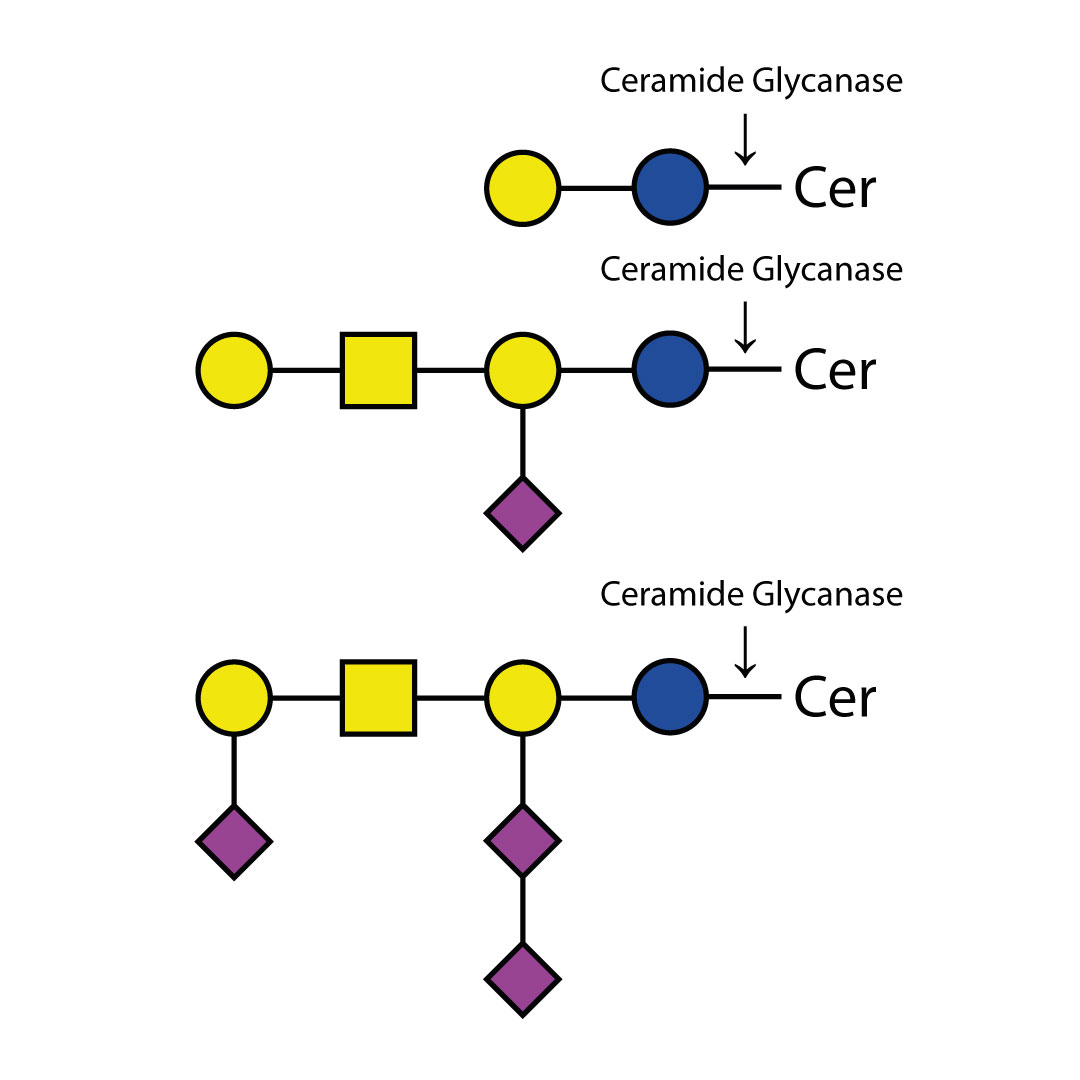
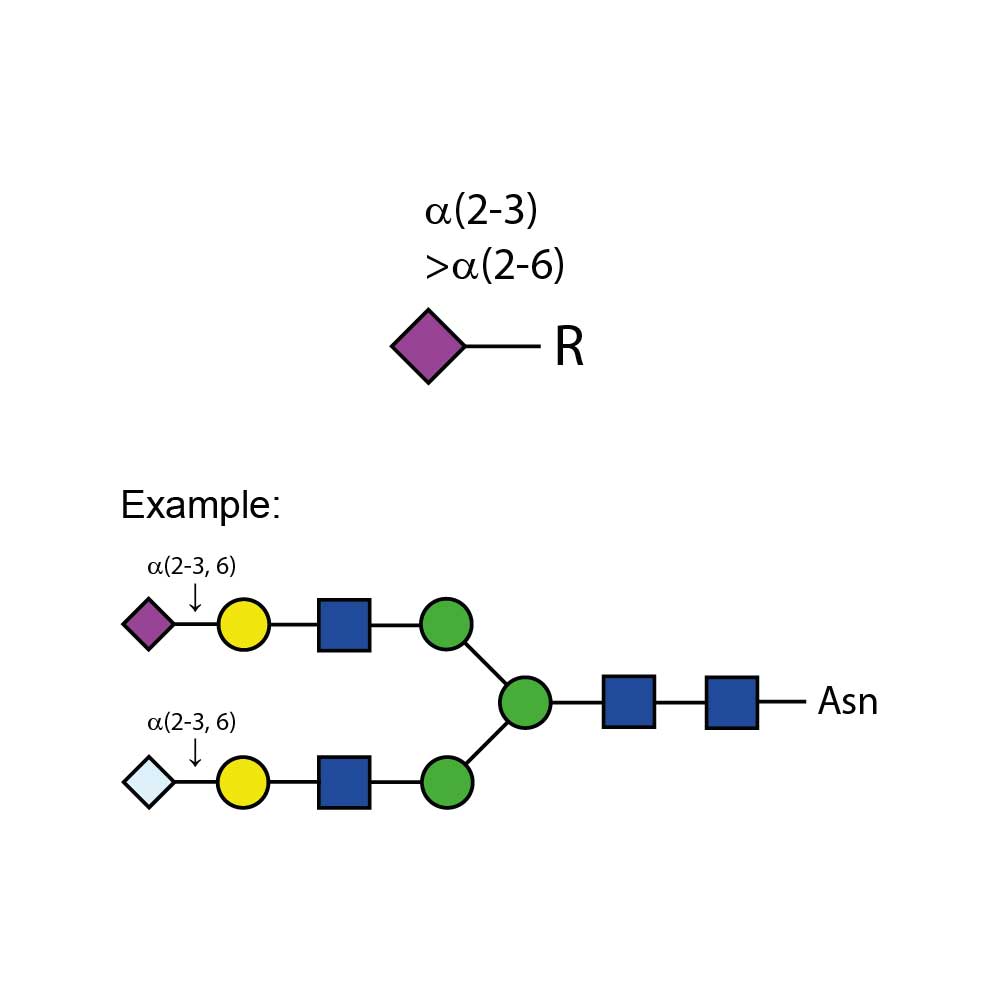
α(2-3,6) 唾液酸酶Cp能够从复杂碳水化合物和糖蛋白中切割所有非还原末端非分支的α(2-3)和α(2-6)唾液酸残基。该酶对α(2-8)或α(2-9)连接键或分支的α(2-3)或α(2-6)连接键没有可检测到的活性。对于不同连接键的相对切割速率依次为:α(2-3) > α(2-6)。
α(2-3,6) 唾液酸酶Cp不会切割分支唾液酸(连接到内部残基)。如需切割α(2-8)或分支唾液酸,请使用α(2-3,6,8,9) 唾液酸酶Au(E-S001)。如仅需切割非还原末端非分支的α(2-3)唾液酸残基,请使用α(2-3)唾液酸酶Sp(E-S007)。
α(2-3,6) 唾液酸酶Cp是从产气荚膜梭菌(Clostridium perfringens)的一个克隆中分离得到的。该酶已通过寡糖标准品进行了广泛表征。
-
0.000.00
-
α(2-3,6) 唾液酸酶Cp能够从复杂碳水化合物和糖蛋白中切割所有非还原末端非分支的α(2-3)和α(2-6)唾液酸残基。该酶对α(2-8)或α(2-9)连接键或分支的α(2-3)或α(2-6)连接键没有可检测到的活性。对于不同连接键的相对切割速率依次为:α(2-3) > α(2-6)。
α(2-3,6) 唾液酸酶Cp不会切割分支唾液酸(连接到内部残基)。如需切割α(2-8)或分支唾液酸,请使用α(2-3,6,8,9) 唾液酸酶Au(E-S001)。如仅需切割非还原末端非分支的α(2-3)唾液酸残基,请使用α(2-3)唾液酸酶Sp(E-S007)。
α(2-3,6) 唾液酸酶Cp是从产气荚膜梭菌(Clostridium perfringens)的一个克隆中分离得到的。该酶已通过寡糖标准品进行了广泛表征。
唾液酸酶(Sialidase),又称神经氨酸酶,是一类能够特异性水解末端唾液酸残基的糖苷酶,在疾病的发生、发展过程中发挥着重要作用,并且在医药领域有着广泛的应用。以下为你详细介绍:
唾液酸酶在疾病发生、发展中的特异性作用
- **病毒感染**
- **流感病毒**:流感病毒表面的唾液酸酶对于病毒的感染和传播至关重要。该酶可以切割宿主细胞表面以及病毒包膜上糖蛋白末端的唾液酸残基,使新组装的病毒颗粒从感染细胞表面释放出来,进而感染其他细胞。此外,唾液酸酶的活性还影响着病毒的致病性和传播能力,不同毒株的唾液酸酶活性差异会导致其致病性的不同。
- **呼吸道合胞病毒**:呼吸道合胞病毒的唾液酸酶有助于病毒在呼吸道上皮细胞间的扩散,通过去除唾液酸,病毒能够逃避宿主免疫系统的识别和清除,从而在体内持续复制和传播,加重呼吸道感染症状。
- **细菌感染**
- **肺炎链球菌**:肺炎链球菌产生的唾液酸酶可以分解宿主细胞表面的唾液酸,破坏呼吸道黏膜的防御屏障,使细菌更容易黏附、定植和侵入宿主细胞,引发肺炎等疾病。同时,唾液酸酶还可能参与细菌逃避宿主免疫反应的过程,降低机体对细菌的清除能力。
- **脑膜炎奈瑟菌**:脑膜炎奈瑟菌的唾液酸酶能够改变细菌表面的抗原结构,帮助细菌躲避宿主免疫系统的攻击,促进其在体内的存活和繁殖,进而导致流行性脑脊髓膜炎的发生和发展 。
- **肿瘤发生与发展**
- **肿瘤转移**:肿瘤细胞表面唾液酸的表达和唾液酸酶的活性变化与肿瘤的转移密切相关。一些肿瘤细胞会高表达唾液酸酶,通过水解自身或周围细胞表面的唾液酸,改变细胞的黏附特性,使肿瘤细胞更容易从原发部位脱落,并在血液循环中存活和迁移,最终在远处器官形成转移灶。
- **免疫逃逸**:肿瘤细胞可以利用唾液酸酶来修饰自身的糖基化模式,干扰机体的免疫识别和杀伤机制,从而逃避免疫系统的监视和攻击,促进肿瘤的生长和发展。
唾液酸酶在医药领域的应用
- **抗病毒药物研发**
- **流感治疗药物**:基于流感病毒唾液酸酶的结构和功能特点,研发出了一系列特异性抑制流感病毒唾液酸酶活性的药物,如奥司他韦、扎那米韦等。这些药物能够竞争性地结合病毒唾液酸酶的活性位点,阻止病毒从感染细胞释放,从而减少病毒的传播和复制,在流感的预防和治疗中发挥了重要作用。
- **其他病毒感染治疗探索**:针对其他利用唾液酸酶进行感染和传播的病毒,如呼吸道合胞病毒等,也在研究开发相应的唾液酸酶抑制剂作为潜在的治疗药物。
- **抗菌药物研发**:针对细菌唾液酸酶开发特异性的抑制剂,有望成为治疗细菌感染的新策略。通过抑制细菌唾液酸酶的活性,可以恢复呼吸道黏膜的防御功能,增强机体对细菌的清除能力,为治疗肺炎链球菌、脑膜炎奈瑟菌等引起的感染提供新的治疗手段。
- **肿瘤诊断与治疗**
- **肿瘤标志物**:由于肿瘤细胞表面唾液酸酶活性和相关糖基化模式的变化,唾液酸酶及其相关产物有可能作为肿瘤诊断的新型生物标志物,用于肿瘤的早期筛查和诊断。
- **靶向治疗**:利用唾液酸酶在肿瘤发生发展中的重要作用,设计针对肿瘤细胞唾液酸酶的靶向治疗药物或策略,如开发能够特异性激活肿瘤细胞内唾液酸酶相关信号通路的抑制剂,或者利用纳米材料负载唾液酸酶抑制剂实现肿瘤部位的精准给药,为肿瘤治疗提供新的思路和方法 。
- **免疫调节剂**:唾液酸酶可以影响免疫细胞的活化和功能,因此一些基于唾液酸酶或其调节剂的免疫调节药物正在研究中,用于治疗自身免疫性疾病、免疫缺陷病等,通过调节机体的免疫反应来达到治疗目的 。
Ludger α(2-3,6) 唾液酸酶Cp能够从复杂碳水化合物和糖蛋白中切割所有非还原末端非分支的α(2-3)和α(2-6)唾液酸残基。该酶对α(2-8)或α(2-9)连接键或分支的α(2-3)或α(2-6)连接键没有可检测到的活性。对于不同连接键的相对切割速率依次为:α(2-3) > α(2-6)。
α(2-3,6) 唾液酸酶Cp不会切割分支唾液酸(连接到内部残基)。如需切割α(2-8)或分支唾液酸,请使用α(2-3,6,8,9) 唾液酸酶Au(E-S001)。如仅需切割非还原末端非分支的α(2-3)唾液酸残基,请使用α(2-3)唾液酸酶Sp(E-S007)。
α(2-3,6) 唾液酸酶Cp是从产气荚膜梭菌(Clostridium perfringens)的一个克隆中分离得到的。该酶已通过寡糖标准品进行了广泛表征。
产品使用说明书:
https://www.qa-bio.com/docs/E-S005.QA-Bio.specsheet.pdf
**产品规格**
**其他名称**:神经氨酸酶、NAN酶、N-乙酰神经氨酸糖苷水解酶、外切α-唾液酸酶
**酶学委员会编号(EC)**:3.2.1.18
**来源**:重组表达于大肠杆菌中的产气荚膜梭菌来源。
**唾液酸酶Cp**:溶于20 mM Tris-HCl,25 mM NaCl,pH 7.5
**5倍反应缓冲液**:250 mM磷酸钠,pH 6.0
**比活性**:>250 U/mg
**活性**:>15 U/mL
**分子量**:41,000道尔顿
**pH范围**:50 mM磷酸钠(pH 6.0)为酶活性提供最佳缓冲条件,以3'-唾液酰乳糖(一种标准底物)为参考。如果由于糖蛋白溶解性或活性要求而在非最佳pH下进行糖苷酶处理,预计酶活性会有所降低。
**建议用法**:
1. 向试管中加入最多100 µg糖蛋白或1 nmol寡糖。
2. 加水至14 µL。
3. 加入4 µL 5倍反应缓冲液。
4. 加入2 µL α(2-3,6)唾液酸酶Cp。
5. 在37°C下孵育1小时。
如果天然蛋白与去唾液酸化蛋白之间的大小差异足以检测,可以通过SDS-PAGE监测去唾液酸化过程。
**特异性**:切割复杂碳水化合物和糖蛋白中所有非还原末端非分支的α(2-3)和α(2-6)唾液酸残基。
**不同连接键的相对切割速率**:α(2-3) > α(2-6)。
**比活性测定**:定义为在37°C、pH 5.0条件下,每分钟从MU-NANA [2'-(4-甲基伞形酮基)-α-D-N-乙酰神经氨酸]产生1 µmol甲基伞形酮所需的酶量。
**储存条件**:将酶储存在4°C。
电话:186 0210 8329
157 1167 5909
cindy.li@ludger.com
QQ:258363672 170439096
Ludger

QQ(Lily): 258363 672 QQ(Cindy): 170 439 096
地 址:上海静安区南京西路1266号