.gif)

-

-
2025 O - 糖苷酶的发现故事,活性检测方法以及作用机制;Ludger 货号:E-G001;参考价RMB 5524元(具体询价)
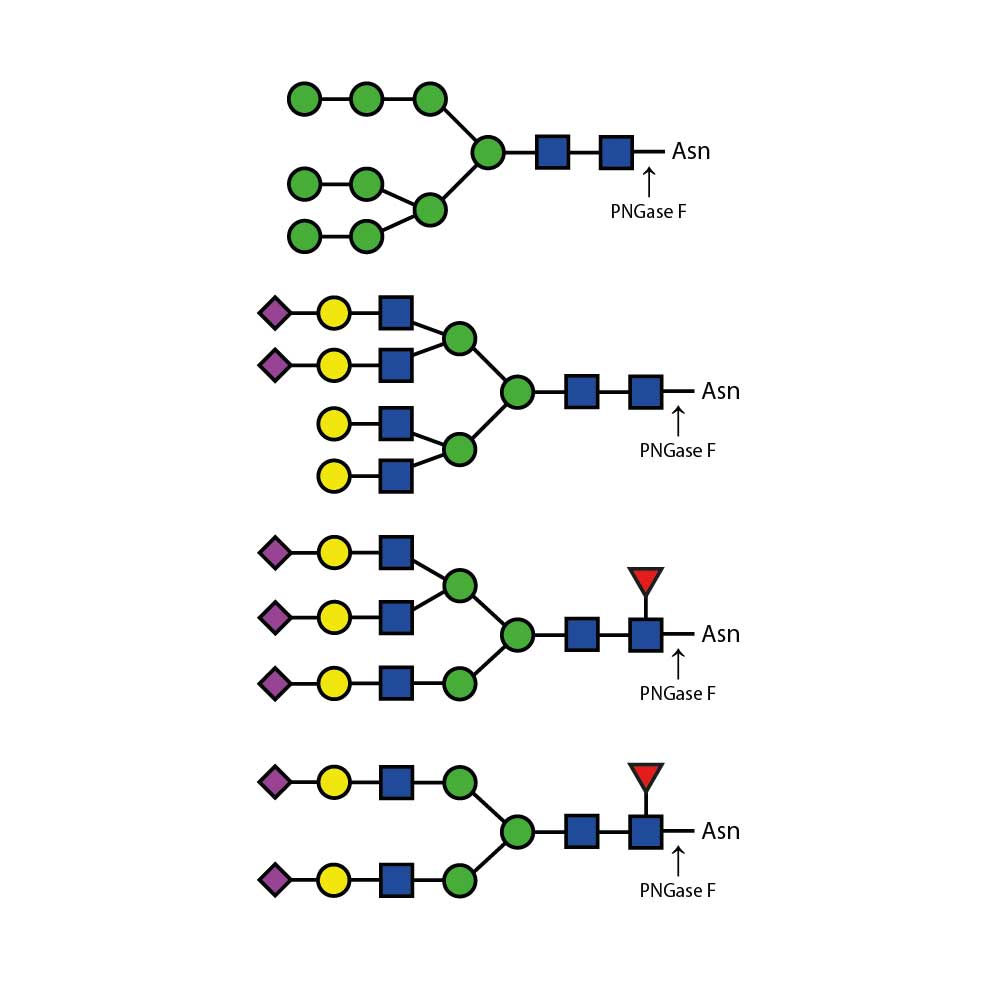
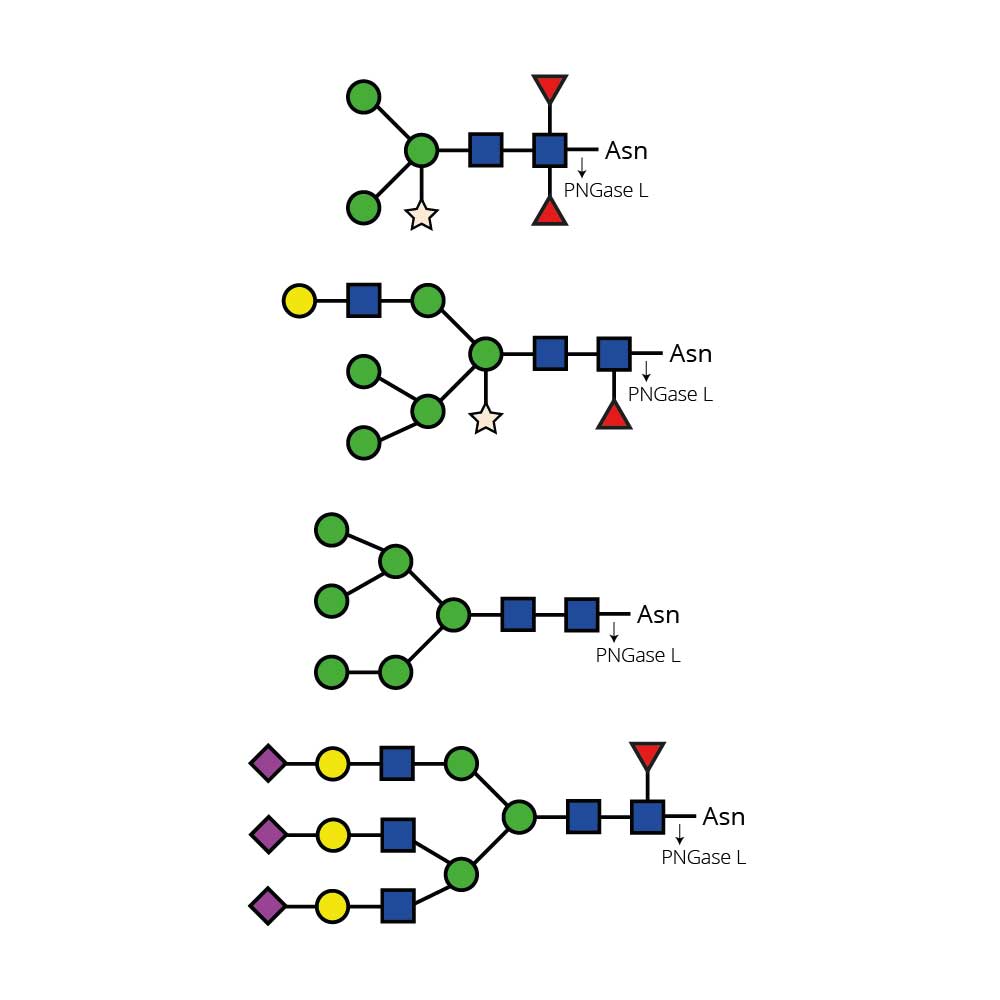
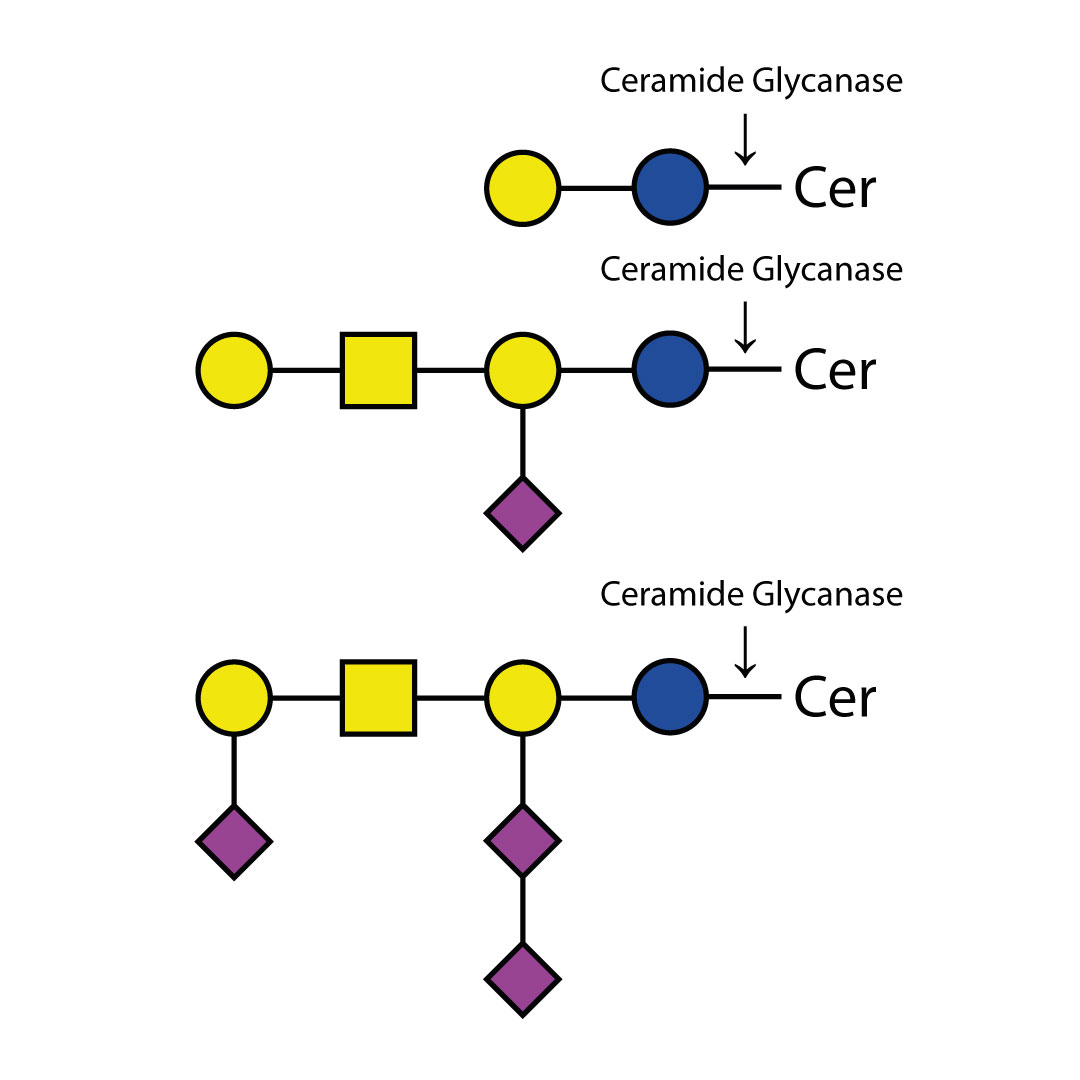
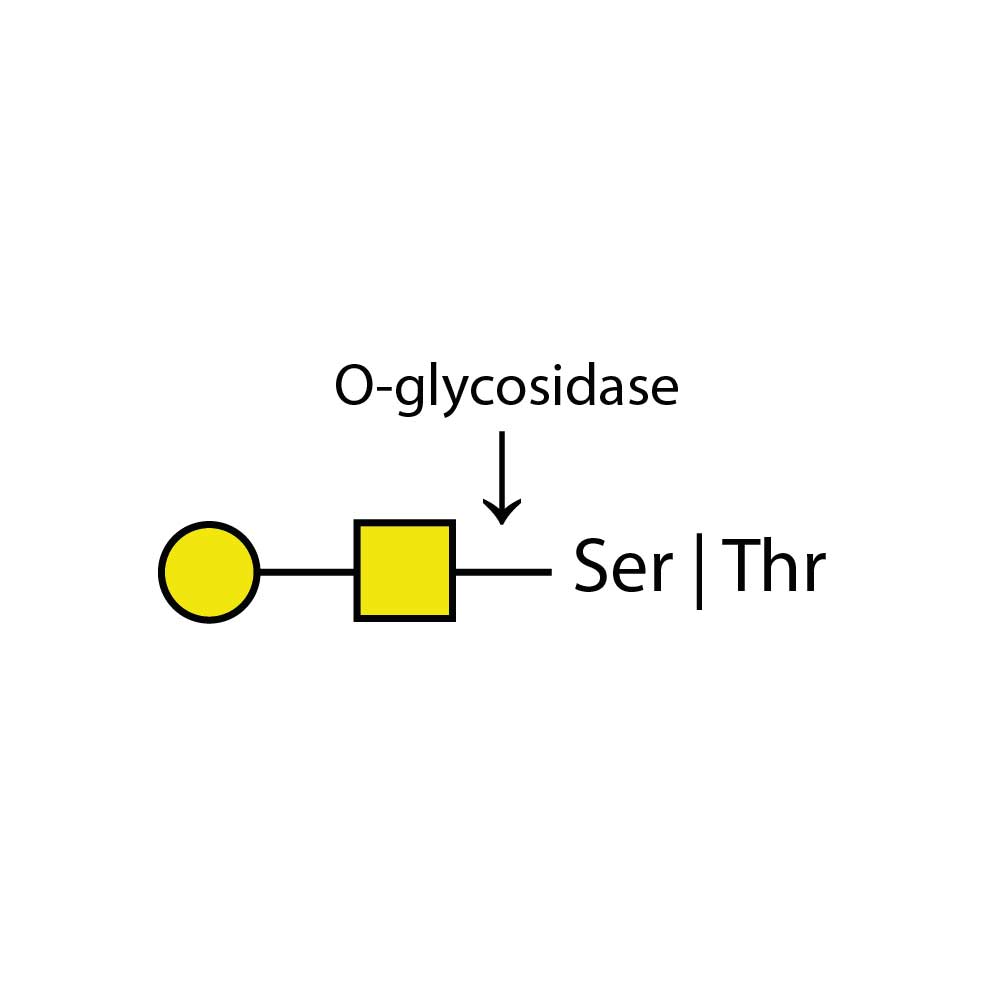
O - 糖苷酶仅能切割连接于糖蛋白或糖肽的丝氨酸或苏氨酸残基上的未取代的Gal - β(1 - 3)GalNAc - α二糖。
像唾液酸、半乳糖、岩藻糖或N - 乙酰葡萄糖胺等取代基必须先使用合适的外切糖苷酶去除后,才能用内切O - 糖苷酶进行处理。至少通常需要一种唾液酸酶,例如产品编号为E - S001的Sialadase Au α(2 - 3,6,8,9),以去除唾液酸。
该试剂盒包含酶和反应缓冲液。足够用于多达60次反应 。
-
0.000.00
-
O - 糖苷酶仅能切割连接于糖蛋白或糖肽的丝氨酸或苏氨酸残基上的未取代的Gal - β(1 - 3)GalNAc - α二糖。
像唾液酸、半乳糖、岩藻糖或N - 乙酰葡萄糖胺等取代基必须先使用合适的外切糖苷酶去除后,才能用内切O - 糖苷酶进行处理。至少通常需要一种唾液酸酶,例如产品编号为E - S001的Sialadase Au α(2 - 3,6,8,9),以去除唾液酸。
该试剂盒包含酶和反应缓冲液。足够用于多达60次反应 。
O - 糖苷酶的发现故事、活性检测方法以及作用机制
一、发现故事
早期探索与背景
在生物化学发展的早期,科学家们就对生物体内的糖类物质以及它们与其他生物分子的相互作用产生了浓厚的兴趣。糖类不仅是生物体的重要能量来源,还在细胞识别、信号传导、免疫反应等众多生理过程中发挥着关键作用。而糖基化修饰,作为糖类参与这些过程的重要方式,其复杂性和多样性逐渐引起了研究者的关注。
在研究糖蛋白和糖脂等糖缀合物的结构与功能过程中,科学家们意识到需要一种能够特异性切割糖苷键的工具酶,以便更好地解析糖基化结构。然而,早期的糖苷酶研究主要集中在其他类型的糖苷键上,对于O - 连接糖苷键的特异性切割工具相对缺乏。
关键突破与发现
20世纪中叶,随着生物化学技术的不断进步,研究人员开始从各种微生物、植物和动物组织中筛选具有特定糖苷酶活性的物质。在一次针对微生物酶活性的大规模筛选实验中,研究人员从某种特定的细菌培养物中发现了一种能够特异性水解O - 连接糖苷键的酶。这种酶能够识别并切割糖蛋白或糖肽中特定的O - 糖苷键,将连接的寡糖链从蛋白质或肽链上释放下来。
经过进一步的纯化和鉴定工作,科学家们确定这是一种新型的糖苷酶,并将其命名为O - 糖苷酶。随后,对O - 糖苷酶的研究逐渐深入,人们对其来源、性质、作用机制等方面有了更详细的了解。随着基因工程技术的发展,研究人员还能够通过基因克隆和表达系统来大量生产重组O - 糖苷酶,进一步推动了其在生物化学、医学和生物技术等领域的广泛应用。
二、活性检测方法
底物特异性检测法
- **原理**:利用O - 糖苷酶对特定O - 糖苷键的水解活性,选择合适的底物,通过检测底物的水解产物来判断酶的活性。常用的底物包括对硝基苯酚标记的O - 糖苷类似物,如对硝基苯酚 - O - 葡萄糖苷(pNP - GlcNAc)等。
- **操作步骤**
1. 将适量的O - 糖苷酶与含有底物的反应缓冲液混合,在适宜的温度和pH条件下孵育一定时间。
2. 孵育结束后,通过加入终止试剂(如酸溶液)停止酶促反应。
3. 利用分光光度计等仪器检测反应产物(如对硝基苯酚)在特定波长下的吸光度变化,根据标准曲线计算出酶的活性。
糖蛋白或糖肽水解检测法
- **原理**:以天然的糖蛋白或糖肽作为底物,通过O - 糖苷酶的作用,观察糖蛋白或糖肽的水解情况,进而评估酶的活性。水解产物可以通过电泳、色谱等方法进行分离和检测。
- **操作步骤**
1. 准备合适的糖蛋白或糖肽样品,将其与O - 糖苷酶在特定的反应体系中孵育。
2. 反应结束后,采用SDS - PAGE电泳分析糖蛋白的水解产物。如果O - 糖苷酶具有活性,糖蛋白上的O - 连接糖链会被切除,导致糖蛋白的分子量发生变化,在电泳图谱上表现为条带位置的改变。
3. 对于糖肽样品,可以使用高效液相色谱(HPLC)等方法分析水解产物的组成和含量变化,从而确定酶的活性。
三、作用机制
底物识别与结合
- O - 糖苷酶具有特定的底物识别位点,能够识别糖蛋白或糖肽中O - 连接糖苷键的结构特征。这些识别位点通常由多个氨基酸残基组成,它们通过与底物上的特定基团(如糖基的羟基、氨基等)发生氢键、静电相互作用等非共价相互作用,实现对底物的特异性识别和结合。
- 例如,O - 糖苷酶的活性中心可能包含一些能够与糖基上的羟基形成氢键的氨基酸残基,这些氢键作用有助于酶与底物紧密结合,确保酶对底物的选择性识别。
催化水解反应
- 一旦O - 糖苷酶与底物结合形成酶 - 底物复合物,酶的活性中心就会通过特定的催化机制促进O - 糖苷键的水解反应。这个过程通常涉及到酶活性中心的氨基酸残基对糖苷键的亲核攻击,从而导致糖苷键的断裂。
- 具体来说,酶活性中心的某些氨基酸残基(如组氨酸、天冬氨酸等)可以作为亲核试剂,攻击O - 糖苷键上的碳原子,形成一个过渡态中间体。随后,水分子参与反应,使过渡态中间体发生裂解,最终导致糖苷键的断裂,释放出相应的寡糖链和残基。
反应特异性与立体化学控制
- O - 糖苷酶在催化水解反应时具有高度的特异性,不仅能够识别特定的O - 糖苷键类型(如GalNAc - Ser/Thr连接),还能够对底物的立体化学结构进行精确的控制。这种特异性和立体化学控制是由酶的活性中心结构和氨基酸残基的排列方式决定的。
- 在催化过程中,酶的活性中心会引导水分子以特定的方向和角度接近糖苷键,从而确保水解反应按照特定的立体化学途径进行,生成具有特定构型的产物。这种精确的反应控制对于维持生物体内糖基化修饰的准确性和多样性具有重要意义。
O - 糖苷酶 Ludger 货号:E-G001
产品说明书:
https://www.qa-bio.com/docs/E-G001.QA-Bio.specsheet.pdf
产品质量规格:
**特异性:**
O - 糖苷酶仅能切割连接于糖蛋白或糖肽的丝氨酸或苏氨酸残基上的未取代的Gal - β(1 - 3)GalNAc - α二糖。
诸如唾液酸、半乳糖、岩藻糖或N - 乙酰葡萄糖胺等取代基必须在用Endo - O - 糖苷酶处理之前,先用合适的外切糖苷酶去除。至少通常需要一种唾液酸酶,例如产品编号为E - S001的Sialadase Au α(2 - 3,6,8,9),以去除唾液酸。
**来源:**
重组表达于大肠杆菌中的肺炎链球菌。
**酶学分类编号(EC):** 3.2.1.97
**试剂盒包含:**
- Ludger O - 糖苷酶
- 60 µL酶溶液(含75 mU酶),溶剂为50 mM磷酸钠缓冲液,pH 7.5。
- 5×反应缓冲液5.0(250 mM磷酸钠缓冲液,pH 5.0)
**比活性:** >12 U/mg
**活性:** >1.25 U/mL
**分子量:** 180,000道尔顿
**pH范围:** 5 - 7,最适pH为5.0
**建议用法:**
1. 向试管中加入最多100 µg的糖蛋白。
2. 加入去离子水定容至总体积13 µL。
3. 加入4 µL的5×反应缓冲液5.0。
4. 加入1 µL的产品编号为E - S001的Sialadase Au α(2 - 3,6,8,9)唾液酸酶。
5. 加入2 µL的O - 糖苷酶。
6. 在37°C下孵育1小时。
**比活性定义:**
在37°C、pH 5.0条件下,1分钟内从对硝基苯基 - 2 - 乙酰氨基 - 2 - 脱氧 - 3 - O - (β - D - 半乳糖吡喃糖基) - α - D - 半乳糖吡喃糖苷产生1 µmol对硝基苯酚(pNP)所需的酶量。
**储存条件:** 将酶储存于4°C。
**稳定性:**
当妥善储存时,至少稳定12个月。暴露于室温数天不会降低酶活性。在反应条件下至少可保持活性5天。
**纯度检测:**
通过如下方法检测O - 糖苷酶中是否存在污染性蛋白酶:将10 µg变性牛血清白蛋白(BSA)与2 µL酶在37°C下孵育24小时。经十二烷基硫酸钠 - 聚丙烯酰胺凝胶电泳(SDS - PAGE)分析处理后的BSA,未发现降解迹象。
电话:186 0210 8329
157 1167 5909
cindy.li@ludger.com
QQ:258363672 170439096
Ludger

QQ(Lily): 258363 672 QQ(Cindy): 170 439 096
地 址:上海静安区南京西路1266号