.gif)

-

-
2025 α-(1 - 3,4)岩藻糖苷酶的发现故事,作用机制,以及在生物制药中的应用Ludger α-(1-3,4)岩藻糖苷酶 货号:E-F134;α-(1-3,4) Fucosidase;参考价RMB 5524元(具体询价)
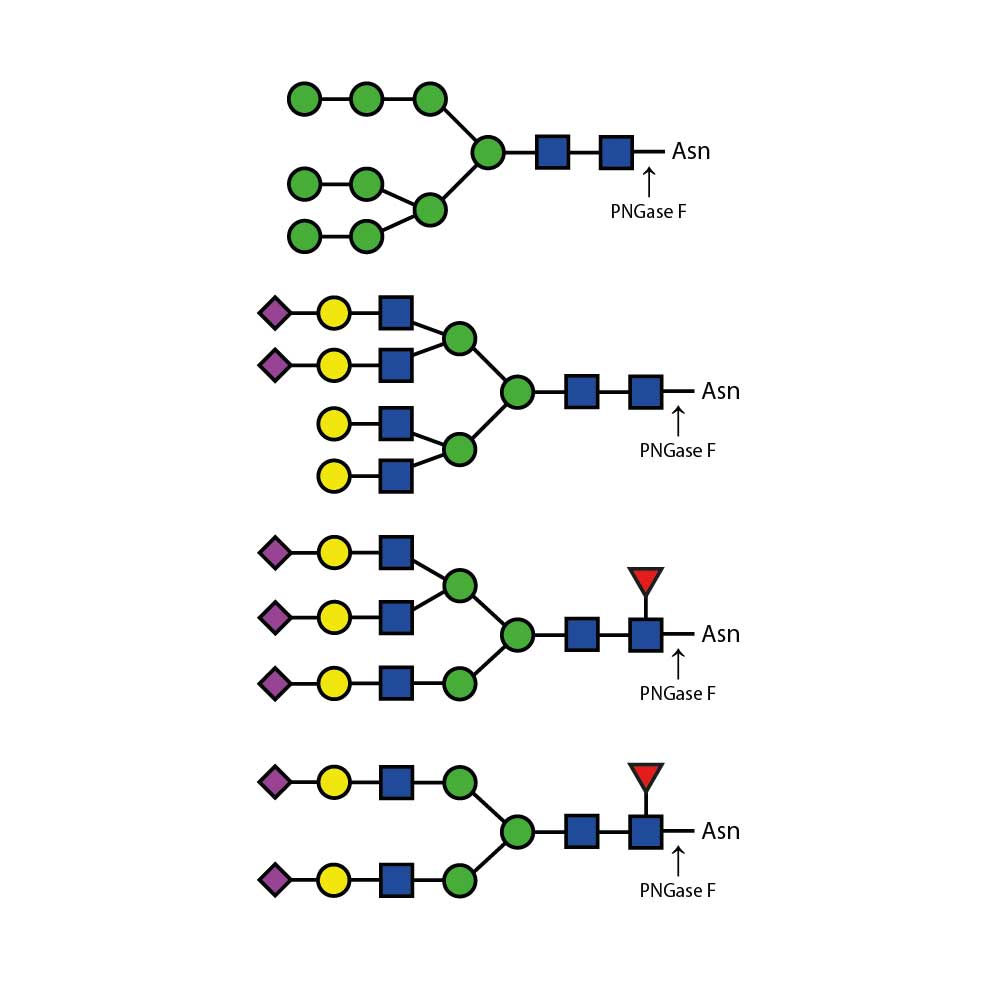
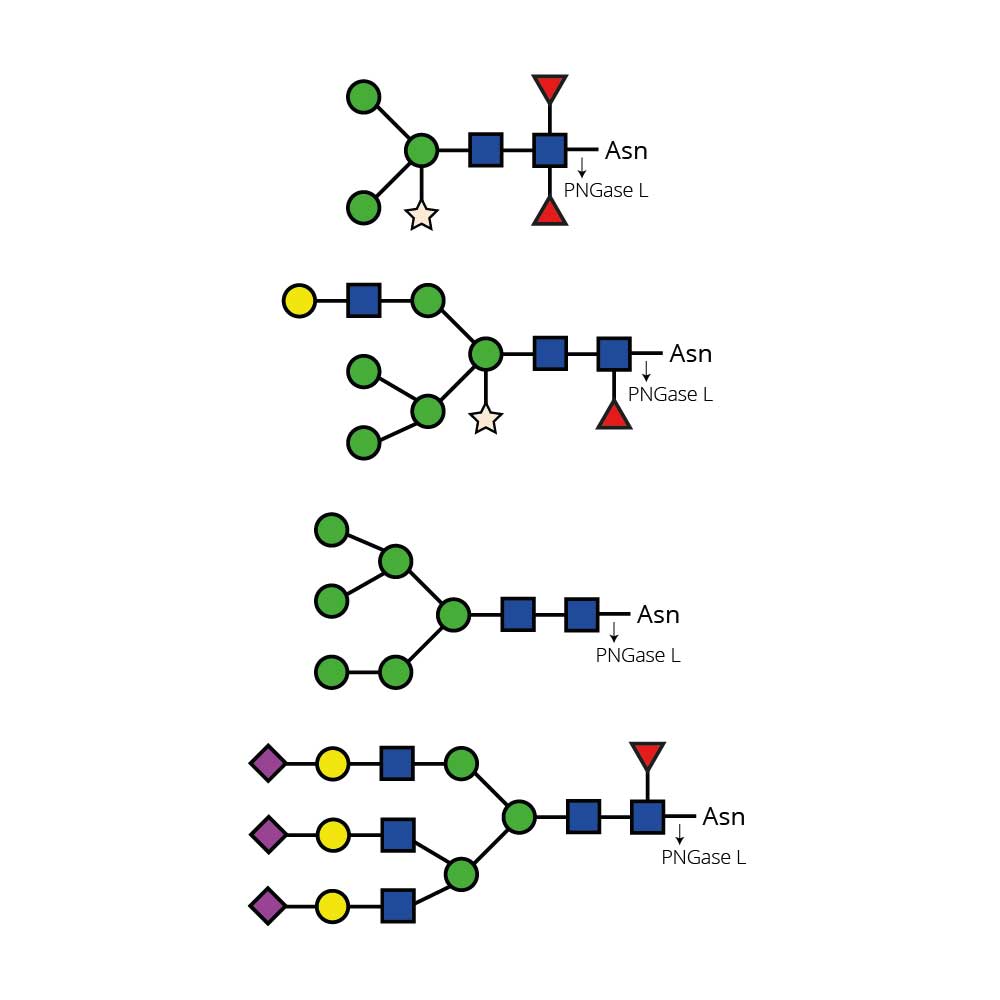
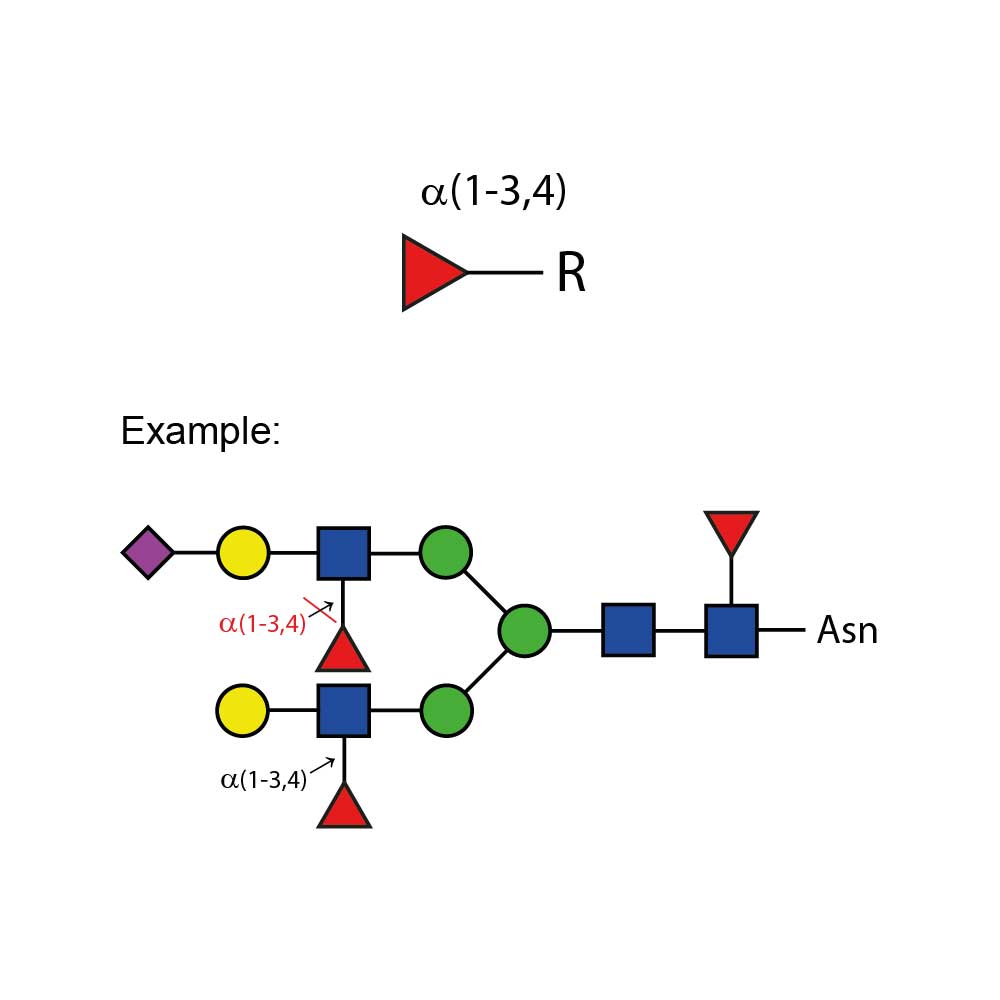
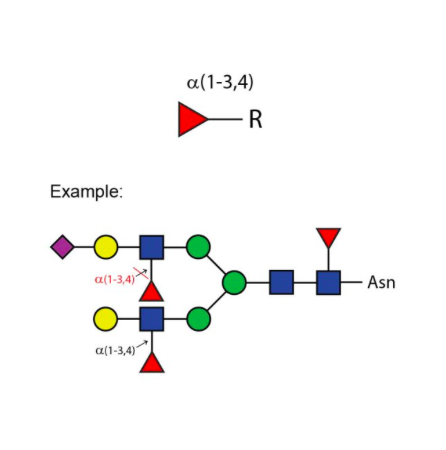
α(1 - 3,4) 岩藻糖苷酶可切割分支的非还原末端岩藻糖,该岩藻糖以α(1 - 3) 或α(1 - 4) 的方式连接于末端Gal - GlcNAc二糖结构中的N - 乙酰葡萄糖胺。若半乳糖上连接有唾液酸(但不是岩藻糖),则会阻断切割反应。
α(1 - 3,4) 岩藻糖苷酶可用于:
- 确定岩藻糖连接方式
- 对带有路易斯结构的糖蛋白进行去糖基化处理
-
0.000.00
-
α(1 - 3,4) 岩藻糖苷酶可切割分支的非还原末端岩藻糖,该岩藻糖以α(1 - 3) 或α(1 - 4) 的方式连接于末端Gal - GlcNAc二糖结构中的N - 乙酰葡萄糖胺。若半乳糖上连接有唾液酸(但不是岩藻糖),则会阻断切割反应。
α(1 - 3,4) 岩藻糖苷酶可用于:
- 确定岩藻糖连接方式
- 对带有路易斯结构的糖蛋白进行去糖基化处理
α-(1 - 3,4)岩藻糖苷酶的发现故事、作用机制及在生物制药中的应用
发现故事
α-(1 - 3,4)岩藻糖苷酶的发现是糖苷酶研究领域不断探索的成果,其过程涉及到多位科学家的努力和对糖类代谢的深入研究。
早期,科学家们在研究生物体内糖类的消化和代谢过程时,注意到某些微生物能够分解特定的糖苷键。随着研究的深入,人们逐渐认识到存在一类能够特异性作用于岩藻糖苷键的酶。在众多研究中,针对α-(1 - 3,4)岩藻糖苷键的水解酶引起了广泛关注。
20世纪中叶,研究人员从一些微生物(如木薯黄单胞菌等)中分离出了能够水解特定糖苷键的酶类。经过一系列的生化分析和鉴定工作,最终确定了α-(1 - 3,4)岩藻糖苷酶的存在,并对其基本性质有了初步的认识。此后,随着分子生物学技术的发展,人们对α-(1 - 3,4)岩藻糖苷酶的结构、基因表达等方面进行了更深入的研究,进一步揭示了其功能和作用机制。
作用机制
α-(1 - 3,4)岩藻糖苷酶主要作用于α-(1 - 3)或α-(1 - 4)糖苷键连接的岩藻糖残基,具体作用机制如下:
底物识别
该酶具有特定的底物结合位点,能够识别并结合含有α-(1 - 3)或α-(1 - 4)糖苷键连接的岩藻糖残基的底物分子。这个结合过程涉及到酶与底物之间的非共价相互作用,如氢键、疏水相互作用和静电相互作用等。底物结合位点的氨基酸残基与底物分子上的特定基团相互匹配,使得酶能够特异性地识别并结合目标底物。
催化反应
一旦底物与酶结合,α-(1 - 3,4)岩藻糖苷酶就会通过其活性中心的催化基团来促进糖苷键的水解反应。催化基团通常是一些具有亲核性的氨基酸残基,如组氨酸、天冬氨酸或谷氨酸等。在反应过程中,催化基团首先与底物分子上的糖苷键发生相互作用,通过酸碱催化或共价催化的方式,使糖苷键发生断裂。
具体来说,酸碱催化机制是指催化基团通过接受或提供质子来改变底物分子的电子云分布,从而降低糖苷键断裂的活化能。共价催化机制则是催化基团与底物分子形成短暂的共价中间体,然后中间体再分解产生产物。在α-(1 - 3,4)岩藻糖苷酶的作用下,α-(1 - 3)或α-(1 - 4)糖苷键连接的岩藻糖残基从底物分子上水解下来,生成相应的产物。
产物释放
反应完成后,生成的产物从酶的活性中心释放出来,使酶恢复到初始状态,以便继续催化下一轮反应。产物释放的过程也涉及到酶与产物之间的相互作用,以及一些构象变化,使得产物能够顺利脱离酶的结合位点。
在生物制药中的应用
糖类药物的生产
- **糖疫苗的制备**:许多病原体的表面存在特定的糖抗原,这些糖抗原可以作为疫苗的靶点。α-(1 - 3,4)岩藻糖苷酶可以用于修饰糖抗原的结构,从而提高糖疫苗的免疫原性和保护效果。例如,在某些细菌感染的研究中,通过使用α-(1 - 3,4)岩藻糖苷酶对细菌表面的糖链进行改造,制备出的糖疫苗能够更有效地诱导机体产生免疫反应,增强对细菌感染的抵抗力。
- **糖蛋白和糖脂类药物的修饰**:许多生物药物,如抗体、细胞因子等,都是糖蛋白或糖脂类药物。糖基化修饰对这些药物的稳定性、活性和药代动力学性质具有重要影响。α-(1 - 3,4)岩藻糖苷酶可以用于精确调控糖基化模式,改善药物的性能。例如,在抗体的生产过程中,通过使用该酶对抗体的糖基化位点进行修饰,可以提高抗体的亲和力、稳定性和抗肿瘤活性。
疾病诊断和监测
- **疾病标志物的检测**:在某些疾病状态下,细胞表面的糖基化模式会发生改变。α-(1 - 3,4)岩藻糖苷酶可以用于检测这些糖基化变化,从而为疾病的诊断提供依据。例如,在癌症的诊断中,癌细胞表面的糖基化模式与正常细胞存在差异,通过使用α-(1 - 3,4)岩藻糖苷酶对细胞表面的糖链进行分析,可以发现特定的糖基化标志物,用于癌症的早期诊断和病情监测。
- **药物疗效的评估**:在治疗过程中,药物可能会影响细胞表面的糖基化模式。通过监测糖基化的变化,可以评估药物的疗效和作用机制。α-(1 - 3,4)岩藻糖苷酶可以作为工具酶,用于分析药物处理前后细胞表面糖基化的差异,为药物的优化和个性化治疗提供参考。
基因治疗和细胞治疗
- **载体的修饰**:在基因治疗和细胞治疗中,常常需要使用载体将基因或细胞导入体内。α-(1 - 3,4)岩藻糖苷酶可以用于修饰载体的表面糖基化模式,提高载体的靶向性和细胞内吞效率。例如,在病毒载体(如腺相关病毒载体)的改造中,通过使用该酶对病毒表面的糖链进行修饰,可以使病毒更有效地感染靶细胞,提高基因治疗的效果。
- **细胞的工程化改造**:在细胞治疗中,对细胞进行工程化改造可以提高细胞的治疗效果。α-(1 - 3,4)岩藻糖苷酶可以用于改造细胞表面的糖基化模式,增强细胞的免疫原性或靶向性。例如,在嵌合抗原受体T细胞(CAR-T细胞)治疗中,通过使用该酶对T细胞表面的糖链进行修饰,可以提高CAR-T细胞对肿瘤细胞的识别和杀伤能力。
产品使用说明:
https://www.qa-bio.com/docs/E-F134.QA-Bio.specsheet.pdf
产品质量规格
来源:从木薯黄单胞菌(Xanthamonas manihotis)中分离得到
酶学分类编号(EC):3.2.1.51
其他名称:α - L - 岩藻糖苷水解酶、α - L - 岩藻糖苷酶、α - (1 - 3,4) 岩藻糖苷酶
试剂盒包含:
Ludger α - (1 - 3,4) - 岩藻糖苷酶
含有α(1 - 3,4) - 岩藻糖苷酶的溶液,溶剂为20 mM Tris - HCl,25 mM NaCl,(pH值7.5)。
5倍反应缓冲液5.0(250 mM磷酸钠,pH值5.0)
比活性:>2 U/mg
活性:0.5 U/mL
分子量:40,000道尔顿
制剂:该酶以无菌过滤溶液形式提供,溶剂为20 mM Tris - HCl,25 mM NaCl,pH值7.5。
建议用法:
1. 向试管中加入最多1纳摩尔的寡糖。
2. 加入去离子水至总体积为15 µL。
3. 加入4 µL的5倍反应缓冲液5.0。
4. 加入1 µL的α(1 - 3,4) - 岩藻糖苷酶。
5. 在37°C下孵育1小时。
特异性:当岩藻糖以α(1 - 3) 或α(1 - 4) 的方式连接于Gal - GlcNAc二糖结构中的GlcNAc时,可作用于非还原末端分支的岩藻糖。若半乳糖上连接有唾液酸(但不是岩藻糖),则会阻断切割反应。
比活性测定:岩藻糖苷酶活性的一个单位定义为在37°C、pH值5.0条件下,1分钟内从路易斯X三糖(Gal β - (1 - 4)[Fuc α - (1 - 3)]GlcNAc)的4 - 甲基伞形酮糖苷中切割下1 µmol岩藻糖所需的酶量。
储存:将酶储存于4°C。
纯度:每一批次的α(1 - 3,4) 岩藻糖苷酶均通过与适当底物在37°C下孵育24小时来检测污染活性;该检测的检测限为5 µU/mL(IUB)。合格的批次应无可检测到的活性。
对于蛋白酶检测,将10 µg变性牛血清白蛋白(BSA)与2 µL酶在37°C下孵育24小时。十二烷基硫酸钠 - 聚丙烯酰胺凝胶电泳(SDS - PAGE)后对BSA条带的分析应显示无降解迹象。
稳定性:在适当储存条件下至少稳定12个月。短时间暴露于室温不会降低活性 。
电话:186 0210 8329
157 1167 5909
cindy.li@ludger.com
QQ:258363672 170439096
Ludger

QQ(Lily): 258363 672 QQ(Cindy): 170 439 096
地 址:上海静安区南京西路1266号