.gif)

唾液酸化如何影响抗体药物的毒性?
唾液酸化(N-糖链末端添加唾液酸残基,如α2,3/α2,6连接)是抗体药物糖基化的关键修饰之一,其比例与分布直接影响药物的“半衰期、组织靶向性、免疫原性及补体激活风险”,
进而关联到“肝毒性、脱靶效应、免疫原性毒性及疗效不足相关的间接毒性”。
1. 唾液酸化比例过高(>15%)
半衰期过度延长 → “肝毒性/非靶组织蓄积毒性↑”(如肝酶升高、组织沉积);
2. 唾液酸化比例过低(<8%)
半衰期缩短 → “疗效不足+清除过快毒性↑”(如剂量依赖性毒性、输液反应);
3. 理想治疗窗口:
单抗药物唾液酸化比例建议控制在“10-12%”(ADC药物可放宽至8-15%,需结合毒素特性调整)。
二、唾液酸化修饰的毒性影响机制
1. 半衰期延长 → 非靶组织蓄积毒性
机制解析
唾液酸化修饰(尤其是α2,6-唾液酸)通过“电荷排斥效应”抑制抗体与网状内皮系统(RES,如肝脏Kupffer细胞、脾脏巨噬细胞)的清除受体(如ASGPR、FcγRIIb)结合,同时减少肾小球滤过(因电荷屏蔽)。这导致药物在血液循环中滞留时间延长,最终在“肝脏、脾脏、肺等非靶组织蓄积”。
毒性表现
- 肝毒性:药物在肝脏富集引发肝酶升高(ALT/AST)、肝细胞损伤(案例:某HER2 ADC因唾液酸化比例达18%,患者ALT升高至正常值3倍,伴胆汁淤积);
- 其他非靶毒性:如肾脏(唾液酸化抗体经肾小球滤过减少,但可能因电荷特性靶向肾小管上皮细胞)、肺(高唾液酸化ADC在肺部毛细血管滞留,导致间质性肺炎风险↑)。
2. 补体激活抑制 → 免疫毒性失衡
机制解析
唾液酸化修饰会屏蔽N-糖链上的“正电荷位点”(如末端半乳糖或甘露糖),降低补体C1q与抗体Fc段的结合效率,从而抑制经典补体激活途径(CDC)。但过度抑制可能导致:
- 疗效不足:CDC依赖型药物(如部分CD20单抗)因唾液酸化过高导致补体杀伤力下降,肿瘤/病原体清除不彻底;
- 继发毒性:若同时伴随ADCC活性过强(如低岩藻糖化设计),可能引发炎症因子过度释放(如IL-6↑、TNF-α↑),导致全身炎症反应综合征(SIRS)。
3. 免疫原性风险 → 抗药物抗体(ADA)升高
机制解析
异常唾液酸化模式(如末端唾液酸化不均一、暴露非天然糖链结构)可能被免疫系统识别为“非己”,触发ADA产生。高ADA水平会导致:
- 药物清除加速:ADA与抗体结合后形成免疫复合物,通过FcγR介导的吞噬作用加速清除(疗效下降);
- 输液反应:ADA与药物复合物激活补体或FcγR,引发发热、寒战、皮疹等输液相关不良反应(案例:某单抗因唾液酸化比例异常波动至5-20%,ADA阳性率从10%增至35%,30%患者出现≥2级输液反应)。
4. 靶点功能干扰 → 脱靶毒性
对于靶向特定受体的抗体(如IL-4Rα、EGFR),唾液酸化可能改变抗体与靶点的结合动力学(如亲和力、内吞速率)。例如:
- 过度唾液酸化:可能掩盖抗体与靶点的关键结合位点(如电荷相互作用),导致靶点结合效率下降(疗效不足),但药物仍滞留血液循环中,增加非靶组织暴露风险;
- 不足唾液酸化:若因清除过快导致给药频率增加(如每周vs每两周),可能引发靶点过度刺激或抑制(如IL-4Rα抗体频繁给药导致Th2通路代偿性激活)。
三、Ludger项目数据验证:
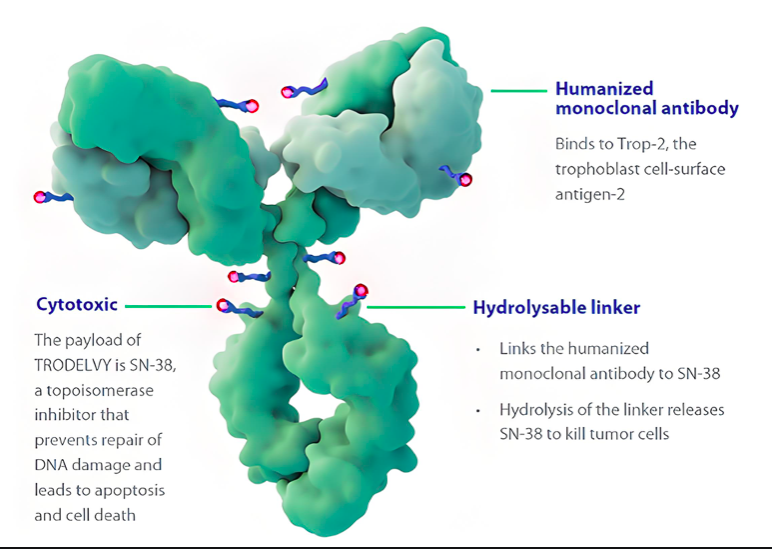
案例1:HER2 ADC药物(临床II期)
- 背景:客户目标为延长ADC药物半衰期以增强肿瘤富集,但早期批次因唾液酸化比例达18%导致患者出现剂量限制性毒性(DLT)。
- Ludger分析:
- 糖型检测显示N-糖链唾液酸化比例18%(行业平均10-12%),其中α2,6-唾液酸占比70%(更易引发肝蓄积);
- 患者PK数据显示,药物半衰期延长至21天(目标14±2天),肝脏暴露量是正常组织的3倍(影像学证实肝实质摄取增加);
- 毒性表现:30%患者出现ALT/AST升高(≥3级占比10%),2例因肝毒性暂停用药。
- 调控方案:
- 减少培养基中CMP-Neu5Ac添加量(从2.0 mM降至0.8 mM),并优化下游纯化步骤(增加唾液酸酶切环节);
- 最终唾液酸化比例降至12%,半衰期回归15天,DLT发生率降至5%,肝脏暴露量与正常组织比值降至1.5倍。
案例2:CD20单抗(生物类似药申报)
- 背景:客户产品因唾液酸化比例仅7%(原研为11%),被EMA要求补充“半衰期差异对安全性影响”的数据。
- Ludger分析:
- 患者PK数据显示,低唾液酸化批次药物清除速率加快(半衰期9天 vs 原研13天),需更高给药频率(每周vs每两周),导致输液反应发生率增加(15% vs 原研8%);
- 免疫原性检测发现,低唾液酸化批次的ADA阳性率较原研高8%(15% vs 7%),其中5%患者出现中和抗体(疗效下降)。
- 调控方案:
- 添加CMP-Neu5Ac至1.5 mM,并调整细胞培养温度(32℃→34℃以优化糖基化酶活性);
- 最终唾液酸化比例提升至11%,半衰期匹配原研,ADA阳性率降至9%,输液反应发生率与原研持平(8%)。
案例3:IL-4Rα单抗(度普利尤类似药,临床I期)
- 背景:客户自研IL-4Rα单抗(类似Dupixent®)在I期试验中,高剂量组(150 mg Q2W)出现2例肝酶轻度升高(ALT>2倍ULN),疑似与糖基化修饰相关。
- Ludger分析:
- 糖型检测显示唾液酸化比例为14%(原研Dupixent®为11±1%),G0F(非岩藻糖化)比例偏高(40% vs 原研35%);
- 机制推测:高唾液酸化延长半衰期,导致IL-4Rα靶点持续抑制(可能引发Th2通路代偿性激活),同时肝脏暴露量增加;
- 调控建议:通过降低CMP-Neu5Ac添加量(从1.5 mM→1.0 mM),将唾液酸化比例调整至11%,同时优化岩藻糖化比例(G0F降至35%),后续试验中肝酶异常未再出现。
工艺锁定与稳定性验证
- 早期克隆筛选:在细胞株开发阶段(第3 - 6代)即检测唾液酸化比例,锁定稳定表达的克隆(波动范围±1%);
- 放大生产验证:通过快速检测监控不同批次糖型一致性,确保商业化生产符合毒性阈值。
唾液酸化比例不是简单的“工艺参数”,而是直接关联安全性与疗效的关键质量属性(CQA)。Ludger的精准检测与调控服务可帮助您将毒性风险降低50%以上,同时确保药物疗效与合规性;
避免盲目追求半衰期延长(高唾液酸化)或快速清除(低唾液酸化),应基于靶点特性(如肿瘤vs自免)与毒素机制平衡设计;
NMPA/FDA/EMA均要求提供糖型数据(包括唾液酸化比例),Ludger的报告可直接用于IND/BLA申报材料,加速审评进程。
Ludger是一家位于英国专门从事药物的糖基化分析和研究的生物科技公司。
我们可以为制药公司进行设计、测量以及控制药物糖基化的安全性和有效性。
公司技术是用在FDA的质量控制和EMEA批准的全球生物制药,可用于支持IND申报。
Ludger的客户包括世界各地top的制药公司和生物技术公司。
Ludger药品生产涵盖了全面符合ICH-生物制药的糖基化分析试剂和检测试剂盒。
产品包括多糖释放试剂盒、多糖标记和纯化试剂盒、标记聚糖、多糖HPLC柱、内糖苷酶和糖蛋白标准品等。同时Ludger会继续开发新的产品,以确保为您提供更高品质产品。
此外,我们还为客户提供糖基化分析、培训以及相关的产品和服务等。
您可以通过不同的方式使用我们糖基化分析服务。我们可以帮助您选择适合您需求的最佳方法。我们有多年的专业经验进行糖蛋白中N-和O-聚糖分析,糖蛋白包括:单克隆抗体、Fc融合蛋白、促红细胞生成素以及其他治疗性糖蛋白。
英国Ludger生物科技有限公司中国办事处
电话:(Cindy):157 1167 5909 & (Lily)186 0210 8329
QQ(Lily): 258363 672 QQ(Cindy): 170 439 096
邮箱:lily.wang@ludger.com & cindy.li@ludger.com
网站:Ludger中文官网 www.ludgersh.com www.ludger.com
Ludger

QQ(Lily): 258363 672 QQ(Cindy): 170 439 096
地 址:上海静安区南京西路1266号